La Comisión Europea concedió este mismo lunes 20/12/21 una autorización condicional de comercialización para la vacuna contra la COVID-19 Nuvaxovid®, desarrollada por la farmacéutica estadounidense Novavax, lo que la convierte en la quinta vacuna contra la COVID-19 autorizada en la Unión Europea (UE) que podrá administrarse a todos los adultos de más de 18 años en dos dosis con 21 días de intervalo.
Esta autorización sigue una recomendación científica favorable basada en una evaluación minuciosa de la seguridad, la eficacia y la calidad de la vacuna por parte de la Agencia Europea del Medicamento (EMA) y cuenta con el respaldo de los Estados miembros. Los resultados de dos ensayos clínicos principales, con más de 45.000 personas, encontraron que Nuvaxovid® fue eficaz para prevenir la COVID-19 en personas a partir de los 18 años. En conjunto, los dos estudios muestran una eficacia de la vacuna Nuvaxovid® de alrededor del 90%. La cepa original de SARS-CoV-2 y algunas variantes preocupantes como Alpha y Beta fueron las cepas virales más comunes que circulaban cuando los estudios estaban en curso. Actualmente, existen datos limitados sobre la eficacia de Nuvaxovid® frente a otras variantes de interés, incluido Omicron.
Nuvaxovid® es la primera vacuna aprobada que utiliza una plataforma diferente, ya que está basada en proteínas recombinantes. Se trata de una tecnología sobre la que existe abundante evidencia científica sobre su seguridad y mucha experiencia en programas de vacunación de calendario. El Ministerio de Sanidad cree que puede servir para convencer a una parte de las personas que aún no han recibido la vacuna y que se muestran reacias a los compuestos de Pfizer y Moderna por considerarlos «experimentales».
Los efectos secundarios que se han observado con Nuvaxovid® en general son leves o moderados y se solventan en pocos días tras la vacunación. Los más frecuentes incluyen sensibilidad y dolor en el lugar de la inyección, cansancio, dolor muscular, dolor de cabeza, malestar general, dolor de articulaciones, náuseas y vómitos.
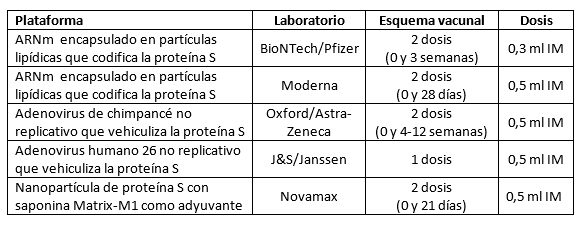
Nuvaxovid® se encuentra entre las vacunas para las que la Unión Europea ha firmado contratos de compra anticipada y, en este contexto, existen más de dos millones de dosis comprometidas por España para las que la compañía tiene que comunicar las entregas. En todo caso, y junto al resto de vacunas disponibles (tabla inferior), corresponde a las autoridades de Salud Pública determinar el eventual uso que pudiera tener Nuvaxovid® en el despliegue de la campaña de vacunación para la COVID-19.
Fuente (consultadas 23/12/2021):
https://ec.europa.eu/commission/presscorner/detail/es/ip_21_6966

Deja una respuesta