¿Qué es un medicamento biológico?
Un medicamento biológico es el que contiene un principio activo derivado de una fuente biológica. Se componen de proteínas con estructuras más grandes y más complejas que las de los medicamentos convencionales. Tanto esta complejidad como la forma en la que se producen, pueden producir cierto grado de variabilidad en las moléculas del mismo principio activo.
Algunos ejemplos de medicamentos biológicos son: REMICADE® (infliximab), HUMIRA® (adalimumab), ENBREL® (etanercept), ORENCIA® (abatacept), STELARA® (ustekinumab), insulina, hormona de crecimiento, eritropoyetina…
¿Cómo se obtienen los medicamentos biológicos?
Al contrario que sucede con los fármacos convencionales, que se fabrican a través de síntesis química, los medicamentos biológicos utilizan procesos más complejos. Pueden ser producidos por diferentes técnicas:
- Directamente por el organismo vivo (como los factores de coagulación extraídos y purificados de plasma humano).
- Por biosíntesis en células vegetales o animales, bacterias, levaduras y virus, mediante técnicas de biología molecular o biotecnológicas.
- La naturaleza de cada línea celular y la complejidad del proceso de fabricación, determinan que cada fármaco biológico, e incluso cada lote, se pueda considerar como un fármaco único.
¿Qué es un medicamento biosimilar?
- Un medicamento biosimilar es un medicamento biológico que se desarrolla para que sea similar a un medicamento biológico ya existente (el medicamento de referencia), y cuya patente ha caducado. Se utiliza para tratar la misma enfermedad, con la misma dosis y vía de administración. La ventaja de los biosimilares es la reducción de costes.
- Los biosimilares no son iguales a los genéricos, que tienen estructuras químicas más simples y se consideran idénticos a sus medicamentos de referencia.
- El principio activo de un biosimilar y su medicamento de referencia es esencialmente la misma sustancia biológica, aunque existen ligeras diferencias debido a la complejidad de su naturaleza y a los métodos de producción.
- En la comercialización de medicamentos biosimilares se exigen más estudios que para los genéricos. Además deben aportar datos preclínicos y clínicos (ensayos clínicos) que respalden que las pequeñas diferencias no afectan a la calidad, a la seguridad y a la eficacia.
- El biosimilar debe ser comparado directamente con el biológico de referencia a lo largo de todo su desarrollo y se le exige estudios de no inferioridad frente al de referencia, (mientras que al de referencia sólo se le exige estudios frente a placebo).
Intercambio o sustitución de biosimilares
En España, los medicamentos biosimilares pueden ser intercambiados o sustituidos por el farmacéutico, siempre que cuente con la conformidad del médico prescriptor y con la del paciente. Es lógico pensar que los pacientes que vayan a iniciar tratamiento con un fármaco biológico lo hagan con un biosimilar, ya que es más económico.
¿Qué es la inmunogenicidad de los fármacos biológicos?
Los fármacos biotecnológicos, tanto los biológicos de referencia como l0s biosimilares, al ser proteínas tienen la capacidad de activar la respuesta inmune. Esto podría producir en algún caso: pérdida de eficacia, aparición de reacciones alérgicas o desarrollo de patologías autoinmunes. Por suerte, actualmente disponemos de numerosos fármacos biológicos distintos; y en caso de que ocurriera, se cambiaría el tratamiento por otro fármaco biológico.
Algunos ejemplos….
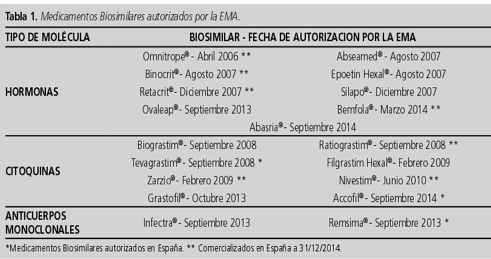
Actualmente, en Europa hay 19 medicamentos biosimilares autorizados:
8 estimulantes de colonias de granulocitos (filgrastim), 5 epoetinas (3 alfa y 2 zeta), 2 hormonas folículo estimulantes (folitropin alfa), 2 anticuerpos monoclonales (infliximab), 1 hormona del crecimiento (somatropin) y 1 insulina glargina.
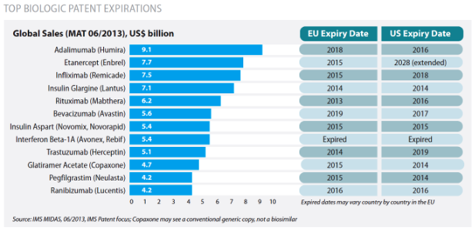
En la tabla se muestran algunos fármacos biológicos cuya patente ha expirado o expirará en los próximos años, y que por tanto disponen o van a disponer de medicamentos biosimilares:

[…] Ver más información en https://tufarmaceuticodeguardia.org/que-es-un-medicamento-biosimilar. […]